ATMP
Was sind ATMP
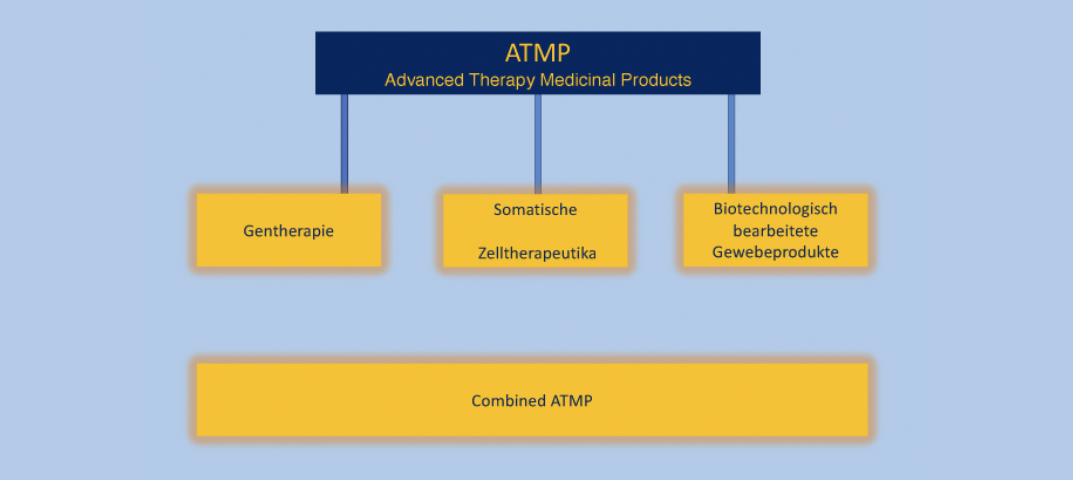
ATMP (Advanced Therapy Medicinal Products) sind Arzneimittel, die auflebenden Zellen oder Geweben basieren und in der Regel für die Behandlung schwerwiegender oder lebensbedrohlicher Krankheiten verwendet werden. Die Anwendung von ATMPs erfordert in der Regel eine spezielle Expertise und Einrichtungen, um die Integrität und Wirksamkeit der Produkte sicherzustellen. Beispiele für ATMPs sind Stammzelltherapien, Gentherapien und Gewebe-Engineering-Produkte.
Rechtliche Grundlage für ATMPs in der EU
In der Europäischen Union wurde vom Europäischen Parlament und vom Rat die Verordnung (EG) Nr. 1394/2007 über Arzneimittel für neuartige Therapien verabschiedet. Sie findet seit dem 30.12.2008 unmittelbar in den Mitgliedstaaten Anwendung (siehe Art. 30 der Verordnung (EG) Nr. 1394/2007 in Verbindung mit Art. 288 Abs. 2 AEUV – Vertrag über die Arbeitsweise der Europäischen Union).
Anwendung von ATMP
Die Anwendung von ATMPs erfolgt in der Regel durch Transplantation, Injektion oder Infusion, wobei die genaue Methode der Verabreichung von der Art des ATMPs abhängt. Die Anwendung von ATMPs erfordert in der Regel eine sorgfältige Überwachung des Patienten und eine engmaschige Nachsorge, um mögliche unerwünschte Wirkungen zu erkennen und zu behandeln bei:
-
Nicht reversiblen Gelenkserkrankungen- oder Traumata
-
Bestimmte Krebserkrankungen
-
Genetische Erkrankungen
-
schweren kardiovaskulären Erkrankungen
Anforderungen
Anforderungen an ATMPs in der Medizin und deren Anwendung sind sehr hoch, da diese Produkte auf lebenden Zellen und Geweben basieren und somit sehr empfindlich sind.
-
Qualitätssicherung
Die Herstellung von ATMPs muss nach den höchsten Qualitätsstandards erfolgen, um die Sicherheit und Wirksamkeit des Produkts zu gewährleisten. Dies umfasst die Einhaltung von GMP (Good Manufacturing Practice)-Richtlinien sowie die Implementierung von Qualitätskontrollen und Qualitätssicherungsverfahren -
Sicherheit
ATMPs müssen sicher sein, um die Gesundheit der Patienten nicht zu gefährden. Hierzu müssen umfangreiche präklinische Studien durchgeführt werden, um mögliche unerwünschte Wirkungen zu identifizieren. In klinischen Studien werden dann die Sicherheit und Wirksamkeit des Produkts weiter untersucht. -
Effektivität
ATMPs müssen effektiv sein, um den Patienten zu helfen. Die Wirksamkeit des Produkts wird in klinischen Studien getestet und muss den Anforderungen der zuständigen Zulassungsbehörde entsprechen. -
Stabilität
ATMPs müssen während der Lagerung und des Transports stabil sein, um ihre Wirksamkeit zu erhalten. Hierzu werden spezielle Lagerungsbedingungen und Transportbedingungen benötigt. -
Dokumentation
Die Dokumentation der Herstellung und Anwendung von ATMPs ist besonders wichtig, um eine lückenlose Rückverfolgbarkeit zu gewährleisten und im Falle von unerwünschten Ereignissen schnell reagieren zu können.
Insgesamt sind die Anforderungen an ATMPs sehr hoch, um die Sicherheit und Wirksamkeit dieser Produkte zu gewährleisten. Die Herstellung und Anwendung von ATMPs erfordert daher spezialisierte Einrichtungen und Experten, um sicherzustellen, dass alle Anforderungen erfüllt werden.